Oksidasi reduksi air Konsepnya
Oksidasi reduksi air Konsepnya
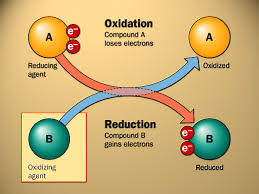
a. Penemuan oksigen
Karena udara mengandung oksigen dalam jumlah yang besar, kombinasi antara zat dan oksigen, yakni oksidasi, paling sering berlangsung di alam. Pembakaran dan perkaratan logam pasti telah menatik perhatian orang sejak dulu. Namun, baru di akhir abad ke- 18 kimiawan dapat memahami pembakaran dengan sebenarnya. Pembakaran dapat dipahami hanya ketika oksigen dipahami. Sampai doktrin Aristoteles bahwa udara adalah unsur dan satu-satunya gas ditolak, mekanisme oksidasi belum dipahami dengan benar. Kemungkinan adanya gas selain udara dikenali oleh Helmont sejak awal abad ke-17. Metoda untuk memisahkan gas tak terkontaminasi dengan uap menggunakan pompa pneumatik dilaporkan oleh Hales di sekitar waktu itu. Namun, walau telah ada kemajuan ini, masih ada satu miskonsepsi yang menghambat pemahaman peran oksigen dalam pembakaran. Miskonsepsi ini adalah teori flogiston yang telah disebutkan di Bab 1. Teori ini dinyatakan oleh dua kimiawan Jerman, Georg Ernst Stahl (1660-1734) dan Johann Joachim Becher. Menurut teori ini, pembakaran adalah proses pelepasan flogiston dari zat yang terbakar. Asap yang muncul dari kayu terbakar dianggap bukti yang baik teori ini. Massa abu setelah pembakaran lebih ringan dari massa kayu dan ini juga konsisten dengan teori flogiston. Namun, ada kelemahan utama dalam teori ini. Residu (oksida logam) setelah pembakaran logam lebih berat dari logamnya. Priestley dan Scheele, yang menemukan oksigen di akhir abad ke-18, adalah penganut teori flogiston . Jadi mereka gagal menghayati peran oksigen dalam pembakaran. Sebaliknya, Lavoiseur, yang tidak terlalu mengenali teori ini, dengan benar memahamo peran oksigen dan mengusulkan teori pembakaran baru yakni oksidasi atau kombinasi zat terbakar dengan oksigen.Ia mendukung teroinya dengan percobaan yang akurat dan kuantitatif yang jauh lebih baik dari standar waktu itu. Ia menyadari bahwa penting untuk memperhatikan kuantitas gas yang terlibat dalam reaksi untuk memahami reaksi kimia dengan cara kuantitatif. Jadi ia melakukan reaksinya dalam wadah tertutup. Peran oksigen dalam pembakaran dikenali Lavoiseur; oksidasi-reduksi didefinisikan sebagai beriku.Oksidasi-reduksi dan oksigen Oksidasi: menerima oksigen Reduksi: mendonorkan oksigen
b. Peran hidrogen
Ternyata tidak semua reaksi oksidasi dengan senyawa organik dapat dijelaskan dengan pemberian dan penerimaan oksigen. Misalnya, walaupun reaksi untuk mensintesis anilin dengan mereaksikan nitrobenzen dan besi dengan kehadiran HCl adalah reaksi oksidasi reduksi dalam kerangka pemberian dan penerimaan oksigen, pembentukan CH3CH3 dengan penambahan hidrogen pada CH2=CH2, tidak melibatkan pemberian dan penerimaan oksigen. Namun, penambahan hidrogen berefek sama dengan pemberian oksigen. Jadi, etena direduksi dalam reaksi ini. Dengan kata lain, juga penting mendefinisikan oksidasi-reduksi dalam kerangka pemberian dan penerimaan hidrogen.
|
Oksidasi-reduksi dan hidrogen Oksidasi: mendonorkan hidrogen Reduksi: menerima hidrogen |
b. Peran elektron
Pembakaran magnesium jelas juga reaksi oksidasi-reduksi yang jelas melibatkan pemberian dan penerimaan oksigen.
2Mg + O2 –> 2MgO (10.1)
Reaksi antara magnesium dan khlorin tidak diikuti dengan pemberian dan penerimaan oksigen.
Mg + Cl2 –> MgCl2 (10.2)
Namun, mempertimbangkan valensi magnesium, merupakan hal yang logis untuk menganggap kedua reaksi dalam kategori yang sama. Memang, perubahan magnesium, Mg –> Mg2++ 2e– , umum untuk kedua reaksi, dan dalam kedua reaksi magnesium dioksidasi. Dalam kerangka ini, keberlakuan yang lebih umum akan dicapai bila oksidasi-reduksi didefinisikan dalam kerangka pemberian dan penerimaan elektron.
Oksidasi-reduksi dan elektronOksidasi: mendonorkan elektron Reduksi: menerima elektron |
Bila kita menggunakan definisi ini, reaksi oksidasi-reduksi dapat dibagi menjadi dua, satu adalah reaksi oksidasi, dan satunya reaksi reduksi. Jadi,
Mg –> Mg2+ + 2 e- (mendonorkan elektron –> dioksidasi) (10.3)
Cl2 + 2e—> 2Cl– (menerima elektron –> direduksi) (10.4)
Masing-masing reaksi tadi disebut setengah reaksi. Akan ditunjukkan bahwa reaksi oksidasi reduksi biasanya paling mudah dinyatakan dengan setengah reaksi (satu untuk oksidan dan satu untuk reduktan).
Contoh soal 10.1 Konstruksi persamaan reaksi oksidasi-reduksi
Tuliskan reaksi oksidasi asam oksalat (COOH)2 menghasilkan CO2 dan air dengan tiga cara; serah terima oksigen, hidrogen dan elektron. Isilah titik-titik dengan rumus kimia dan koefisien yang tepat.
- oksigen: (COOH)2+(O) –> ….+….
- hidrogen: (COOH)2 –> 2H + ……
- elektron: (COOH)2–> 2e- + …..+ …….
Jawab
- oksigen: H2O terbentuk dari dua H dari asam oksalat dan satu O dari oksidan (COOH)2+(O) –> 2 CO2 + H2O
- hidrogen: secara formal asam oksalat memberikan dua hidrogen dan CO2 (COOH)2 –>2H + 2CO2
- elektron: metoda untuk menyusun reaksi jenis ini akan dibahas selanjutnya (COOH)2–>2e- + 2CO2 + 2H+
d. Oksidan dan reduktan (bahan pengoksidasi dan pereduksi)
Oksidasi reduksi seperti dua sisi dari selembar kertas, jadi tidak mungkin oksidasi atau reduksi berlangsung tanpa disertai lawannya. Bila zat menerima elektron, maka harus ada yang mendonorkan elektron tersebut.
Dalam oksidasi reduksi, senyawa yang menerima elektron dari lawannya disebut oksidan (bahan pengoksidasi sebab lawannya akan teroksidasi. Lawan oksidan, yang mendonorkan elektron pada oksidan, disebut dengan reduktan (bahan pereduksi) karena lawannya (oksidan tadi tereduksi. Di antara contoh di atas, magnesium, yang memberikan elektron pada khlorin, adalah reduktan, dan khlorin, yang menerima elektron dari magnesium, adalah reduktan. Umumnya, unsur elektropositif seperti logam alkali dan alkali tanah adalah reduktan kuat; sementara unsur elektronegatif seperti khlorin adalah oksidan yang baik.
Suatu senyawa dapat berlaku sebagai oksidan dan juga reduktan. Bila senyawa itu mudah mendonorkan elektron pada lawannya, senyawa ini dapat menjadi reduktan. Sebaliknya bila senyawa ini mudah menerima elektron, senyawa itu adalaj oksidan. Tabel 10.1, mendaftarkan setengah reaksi oksidan dan reduktan yang umum.
Tabel 10.1 Beberapa oksidan dan reduktan
Oksidan
I2(aq) + 2 e––> 2I–(aq)
Br2(aq) + 2e––> 2Br–(aq)
Cr2O72–(aq) + 14H+(aq) + 6e––> 2Cr3+(aq) + 7H2O(l)
Cl2(aq) + 2e––> 2Cl–(aq)
MnO4 –(aq) + 8H+(aq) + 5e––> Mn2+(aq) + 4H2O(l)
S2O82–(aq) + 2e––> 2SO42-(aq)
Reduktan
Zn(s) –> Zn2+(aq) + 2e–
H2(g) –> 2H+(aq) + 2e–
H2S(aq) –> 2H+(aq) + S(s) + 2e–
Sn2+(aq) –> Sn4+(aq) + 2e–
Fe2+(aq) –> Fe3+(aq) + e–
e. Bilangan oksidasi
Besi adalah reduktan yang baik dan besi menjadi Fe2+ atau Fe3+ bergantung kondisi reaksi.
Fe –> Fe2+ +2e– (10.5)
Fe –> Fe3+ +3e– (10.6)
Jadi, penting untuk menyatakan dengan jelas jumlah elektron yang diserahkan atau diterima. Untuk keperluan ini, suatu parameter, bilangan oksidasi didefinisikan. Bilangan oksidasi untuk unsur monoatomik adalah muatan atom tersebut. Bilangan oksidasi Fe, Fe2+ dan Fe3+ adalah 0, +2 dan +3.
Oksidasi reduksi air Konsepnya
Untuk memperluas konsep bilangan oksidasi pada molekul poliatomik, penting untuk mengetahui distribusi elektron dalam molekul dengan akurat. Karena hal ini sukar, diputuskan bahwa muatan formal diberikan pada tiap atom dengan menggunakan aturan tertentu, dan bilangan oksidasi didefinisikan berdasarkan muatan formal. Ringkasan definisinya diberikan sebagai berikut.
Definsi bilangan oksidasi
- bilangan oksidasi unsur (termasuk alotrop) selalu 0.
- bilangan oksidasi oksigen adalah -2 kecuali dalam peroksida, -1.
- bilangan oksidasi hidrogen adalah +1 kecuali dalam hidrida logam -1.
- bilangan oksidasi logam alkali +1 dan logam alkali tanah +2.
- Untuk ion dan molekul poliatomik, bilangan oksidasi setiap atom didefinisikan sehingga jumlahnya sama dengan muatannya.
Contoh soal 10.2 penentuan bilangan oksidasi
Dalam peleburan timbal dari bijihnya (timbal sulfida) reaksi reduksi oksidasi dua tahap berikut terjadi. Tunjukkan oksidan dan reduktan dalam reaksi ini dan tentukan bilangan oksidasi masingmasing atomnya.
Jawab
Bilangan oksidasi masing-masing atom ditandai di bawah simbol atomnya.
| 2PbS(s) | + | 3O2(g) | –> | 2PbO(s) | + | 2SO2(g) | |
| +2 -2 | 0 | +2 -2 | +4 -2 |
| PbO(s) | + | CO(g) | –> | Pb(s) | + | CO2(g) | |
| +2 -2 | +2 -2 | 0 | +4 -2 |
Tahap pertama reaksi, bilangan oksidasi S berubah dari -2 ke +4, dengan demikian S dioksidasi. Jadi PbS adalah reduktan. Bilangan oksidasi O turun dari 0 ke -2. Jadi oksigen adalah oksidan. Di tahap kedua, bilangan oksidasi C berubah dari +2 ke +4, dan dengan demikian C dioksidasi. Jadi CO adalah reduktan. Bilangan oksidasi Pb turun dari +2 ke 0. Jadi PbO adalah oksidan. Dalam peleburan logam semacam besi, CO sering menjadi reduktan.
f. Penyusunan persamaan reduksi oksidasi
Persamaan oksidasi reduksi seperti dalam Tabel 10.1 dapat dengan mudah dibuat dengan prosedur berikut.
Penyusunan setengah reaksi oksidasi reduksi
|
Sekali setengah reaksi telah disusun, mudah untuk menyusun persamaan reduksi oksidasi keseluruhan. Dalam oksidasi reduksi, penurunan bilangan oksidasi oksidan dan kenaikan bilangan oksidasi reduktan harus sama. Hal ini sama dengan hubungan ekivalen dalam reaksi asam basa.
Penyusunan reaksi oksidasi reduksi total
|
Sebagai contoh, reaksi oksidasi iodin dengan kalium permanganat KMnO4 adalah sebagai berikut.
(1) persamaan untuk oksidan
- MnO4 – –> Mn2+
- MnO4– –> Mn2+ + 4H2O
- MnO4– +8H+–> Mn2+ + 4H2O
- MnO4– +8H+ + 5e– –> Mn2+ + 4H2O (setengah reaksi) (10.5)
(2) persamaan untuk reduktan
- I– –> 1/2 I2
- I– –> 1/2 I2 + e–
2I– –> I2 + 2e– (setengah reaksi) (10.6) Catat bahwa reaksi kedua ini dikalikan dua untuk menghindari pecahan.
(3) Jumlah reaksi oksidan dan reduktan
- 2MnO4– + 16H+ +10e– –> 2Mn2+ + 8H2O
10I– –> 5I2 + 10e–
- 2MnO4– + 16H+ + 10I– –> 2Mn2+ + 5I2 + 8H2O (reaksi keseluruhan) (10.7)
Lihat jumlah elektronnya akan saling meniadakan.
- 2KMnO4 + 8H2SO4+ 10KI –> 2MnSO4+ 5I2 + 8H2O + 6K2SO4 (10.8)
Persamaan di atas didapatkan dengan menambahkan sejumlah ion lawan ke kedua sisi persamaan sehingga semua ion yang terlibat akan melengkapi persamaan okisdasi reduksi ini.
Contoh soal 10.3 Oksidasi toluen
C6H5CH3 dioksidasi menjadi asam benzoat C6H5COOH dengan KMnO4 dalam H2SO4.
Tuliskan persamaan oksidasi reduksinya.
Jawab
Persamaan untuk oksidannya telah diberikan di atas.
Persamaan bagi reduktan (toluen) diperoleh sebagai berikut.
a) C6H5CH3 + 2H2O –> C6H5COOH
b) C6H5CH3 + 2H2O –> C6H5COOH + 6H+
c) C6H5CH3 + 2H2O –> C6H5COOH + 6H++6e–
d) persamaan untuk oksidan ini dikalikan 6, dan untuk reduktan dikalikan 5 sehingga jumlah elektron yang terlibat di kedua reaksi identik (= 30).
f) Jumlah dua reaksi (elektron akan saling meniadakan)
6MnO4– + 48 H+ +30e––> 6Mn2+ + 24H2O 5C6H5CH3 + 10H2O –> 5C6H5COOH + 30H++30e–
5C6H5CH3 +6MnO4– + 18 H+–> 5C6H5COOH + 6Mn+2
g) 6 K+ + 9 SO4-2 ditambahkan kedua sisi untuk melengkapi reaksi.
5C6H5CH3 + 6KMnO4 + 9H2SO4 –> 5C6H5COOH + 6Mn SO4 + 3K2SO4+ 14H2O
Stoikiometri oksidasi reduksi
Jumlah kuantitatif oksidan dan reduktan sehingga reaksi oksidasi reduksi oksidasi lengkap mirip dengan stoikiometri asam basa.
| Stoikiometri oksidasi reduksi
noMoVo = nRMRVR jumlah mol elektron yang diterima = jumlah mol elektron yang diserahkan subskrip O dan R adalah oksidan dan reduktan, n adalah perubahan bilangan oksidasi, M konsentrasi molar dan V volume oksidan dan reduktan. |
Prinsip yang terlibat dalam titrasi oksidasi reduksi secara prinsip identik dengan dalam titrasi asam basa. Dalam titrasi reduksi oksidasi, pilihan indikatornya untuk menunjukkan titik akhir terbatas. Kadang hantaran larutan digunakan sebagai indikator.
Contoh soal 10.4 Konsentrasi hidrogen peroksida
Larutan hidrogen peroksida komersial H2O2 diencerkan 150 kali. 25,0 cm3 sampel larutan dititrasi dengan larutan KMnO4 0,02 mol dm-3, dan 26,3 cm3 diperlukan untuk mencapai titik akhir. Hitung konsentrasi molar (mol dm–3) H2O2.
Jawab
Hidrogen peroksida berperan sebagai reduktan dalam reaksi ini, setengah reaksinya adalah
H2O2 –> O2 + 2H+ + 2e–
Ini berarti 5 mol H2O2 dan 2 mol KMnO4 ekivalen satu sama lain. Konsentrasi molar MR hidrogen peroksida dihitung sebagai berikut.
5 x 0,02 (mol dm-3) x 26,3 x 10-3 (dm3)= [2 x MR (mol dm-3) x 25,0 x 10-3 (dm3)]/150
MR = 7,89 (mol dm-3)
Oksidasi reduksi air Konsepnya





